製品情報(ドラッグ・インフォメーション)
電子化された添付文書2022年6月改訂(第3版)に基づき作成
| 日本標準商品分類番号 |
876169 |
| 承認番号 |
30300AMX00245000 |
| 承認年月 |
2021年3月 |
| 薬価基準収載年月 |
2021年5月 |
| 販売開始年月 |
2021年7月 |
| 再審査期間満了年月 |
6年(2027年3月満了) |
| 国際誕生年月 |
2018年9月 |
- 貯 法:
- 凍結を避け、2〜8℃で保存
- 有効期間:
- 36ヵ月
2
禁忌
- 2.
- 禁忌(次の患者には投与しないこと)
- 本剤の成分並びに他のアミノグリコシド系抗生物質又はバシトラシンに対し過敏症の既往歴のある患者
3
組成・性状
- 3.1
- 組成
| 品 名 |
アリケイス吸入液 590mg |
| 有効成分 |
1バイアル(8.4mL)中にアミカシン硫酸塩をアミカシンとして590mg(力価)含有 |
| 添加物 |
ジパルミトイルホスファチジルコリン(DPPC)
コレステロール
水酸化ナトリウム
塩化ナトリウム |
※タップすると画像が拡大します。

本剤は専用のネブライザにより薬液8.4mLが投与できるように、1バイアル中に薬液8.9mLが充填されている。
- 3.2
- 剤形・性状
| 品 名 |
アリケイス吸入液 590mg |
| 剤形・性状 |
白色の乳状懸濁液 |
| pH |
6.1~7.1 |
| その他 |
無菌製剤 |
※タップすると画像が拡大します。

4
効能又は効果
- 適応菌種:
- アミカシンに感性のマイコバクテリウム・アビウムコンプレックス(MAC)
- 適応症:
- マイコバクテリウム・アビウムコンプレックス(MAC)による肺非結核性抗酸菌症
5
効能又は効果に関連する注意
- 5.1
- 本剤の適用は、肺MAC症に対する多剤併用療法による前治療において効果不十分な患者に限定すること。
6
用法及び用量
通常、成人にはアミカシンとして 590 mg(力価)を1日1回ネブライザを用いて吸入投与する。
7
用法及び用量に関連する注意
- 7.1
- 本剤を吸入する際には、専用のネブライザであるラミラネブライザシステムを使用すること。[14.1参照]
- 7.2
- 使用にあたっては、ガイドライン等を参照し、多剤併用療法と併用すること。
- 7.3
- 喀痰培養陰性化が認められた以降も、一定期間は本剤の投与を継続すること。臨床試験においては、喀痰培養陰性化が認められた以降に最大12ヵ月間、本剤の投与を継続した。[17.1.1参照]
- 7.4
- 投与開始後12ヵ月以内に喀痰培養陰性化が得られない場合は、本剤の継続投与の必要性を慎重に再考すること。
8
重要な基本的注意
- 8.1
- めまい、耳鳴、難聴等の第8脳神経障害があらわれることがあるので、特に血中濃度が高くなりやすい患者(腎機能障害患者、高齢者、長期間投与患者等)では聴力検査を実施することが望ましい。[11.1.3参照]
- 8.2
- 急性腎障害があらわれることがあるので、定期的に腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.4参照]
- 8.3
- ショック、アナフィラキシーがあらわれることがあるので、アレルギー既往歴、薬物過敏症等について十分な問診を行うこと。[11.1.5参照]
9
特定の背景を有する患者に関する注意
- 9.1
- 合併症・既往歴のある患者
- 9.1.1
- 第8脳神経障害又はその疑いのある患者
第8脳神経障害が発現又は増悪するおそれがある。[11.1.3参照]
- 9.1.2
- 重症筋無力症等の神経筋障害又はその疑いのある患者
本剤は神経筋遮断作用を有するため、呼吸抑制があらわれることがある。
- 9.2
- 腎機能障害患者腎機能障害患者では高い血中濃度が持続し、腎障害の悪化及び第8脳神経障害の副作用が強くあらわれるおそれがある。腎機能障害患者を対象とした臨床試験は実施していない。[8.1、11.1.3参照]
- 9.5
- 妊婦妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合のみ投与すること。妊婦に投与すると新生児に第8脳神経障害があらわれるおそれがある。
- 9.6
- 授乳婦治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤吸入投与によるヒト母乳中への移行は不明であるが、アミカシンを筋肉内投与した場合、ヒト母乳中に移行することが報告されている。
- 9.7
- 小児等小児等を対象とした臨床試験は実施していない。
- 9.8
- 高齢者一般に生理機能が低下しているため、高い血中濃度が持続し、第8脳神経障害等の副作用が強くあらわれるおそれがある。
10
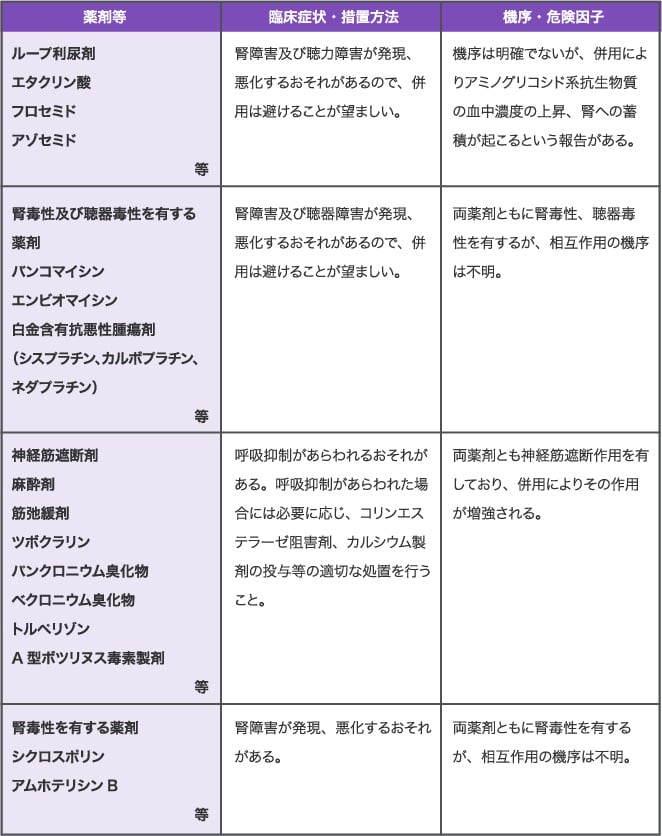
相互作用
- 10.2
- 併用注意
| 薬剤等 |
臨床症状・措置方法 |
機序・危険因子 |
ループ利尿剤
エタクリン酸
フロセミド
アゾセミド等 |
腎障害及び聴力障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 |
機序は明確でないが、併用によりアミノグリコシド系抗生物質の血中濃度の上昇、腎への蓄積が起こるという報告がある。 |
腎毒性及び聴器毒性を有する薬剤
バンコマイシン
エンビオマイシン
白金含有抗悪性腫瘍剤
(シスプラチン、カルボプラチン、ネダプラチン)等 |
腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 |
両薬剤ともに腎毒性、聴器毒性を有するが、相互作用の機序は不明。 |
神経筋遮断剤
麻酔剤
筋弛緩剤
ツボクラリン
パンクロニウム臭化物
ベクロニウム臭化物
トルペリゾン
A型ボツリヌス毒素製剤等 |
呼吸抑制があらわれるおそれがある。呼吸抑制があらわれた場合には必要に応じ、コリンエステラーゼ阻害剤、カルシウム製剤の投与等の適切な処置を行うこと。 |
両薬剤とも神経筋遮断作用を有しており、併用によりその作用が増強される。 |
腎毒性を有する薬剤
シクロスポリン
アムホテリシンB等 |
腎障害が発現、悪化するおそれがある。 |
両薬剤ともに腎毒性を有するが、相互作用の機序は不明。 |
※タップすると画像が拡大します。
11
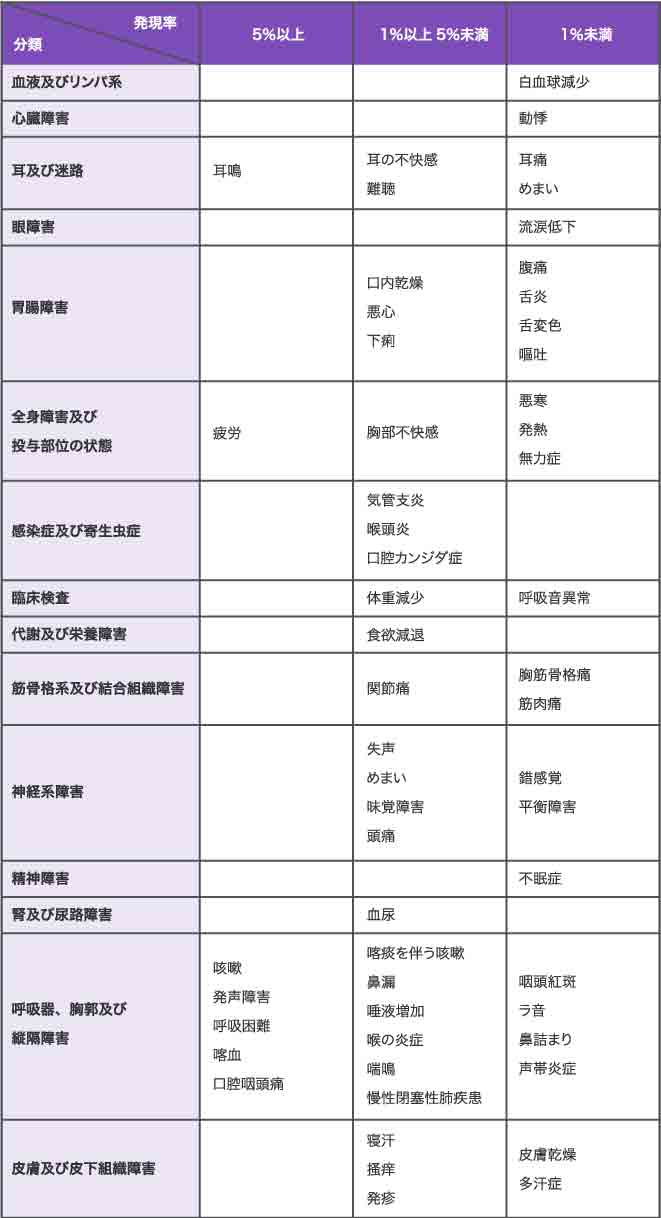
副作用
- 11.1
- 重大な副作用次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 11.1.1
- 過敏性肺臓炎(2.7%)
- 11.1.2
- 気管支痙攣(21.5%)
- 11.1.3
- 第8脳神経障害(15.1%)
めまい、耳鳴、難聴等の第8脳神経障害があらわれることがある。[8.1参照]
- 11.1.4
- 急性腎障害(3.2%)
[8.2参照]
- 11.1.5
- ショック(頻度不明)、アナフィラキシー(頻度不明)
[8.3参照]
- 11.2
- その他の副作用
※タップすると画像が拡大します。
13
過量投与
アミカシンの除去には血液透析が有用であるとの報告がある。
- 14.1
- 薬剤交付時の注意ラミラネブライザシステムの使用方法を患者に十分に指導すること。[7.1参照]
- 14.2
- 薬剤投与時の注意本剤は使用前に室温20~25℃に戻してから使用すること。使用時にはバイアルを少なくとも10~15秒間激しく振り混ぜ、内容物が均一でよく混ざるようになるまで本剤を調製する。
20
取扱い上の注意
凍結を避け、冷蔵庫に保管(2℃-8℃)。
アリケイスは、最大25℃の室温で最大4週間保存が可能である。一旦室温で保存された場合、未使用の薬剤は4週間で廃棄する必要がある。
21
承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22
包装
アリケイス吸入液 590mg:7バイアル
※タップすると画像が拡大します。
詳細は電子化された添付文書をご参照ください。また、電子化された添付文書の改訂にご留意ください。