- 11.1
- 重大な副作用
- 11.1.3
- 第8脳神経障害(15.1%)めまい、耳鳴、難聴等の第8脳神経障害があらわれることがある。
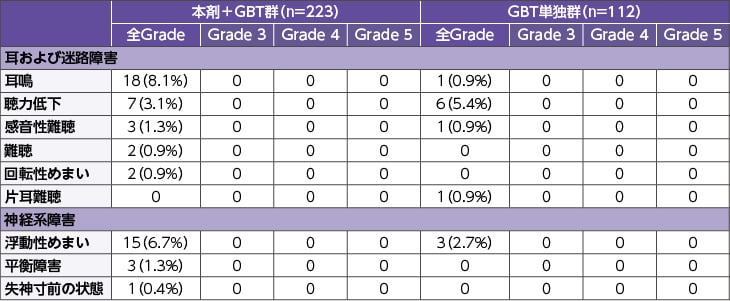
本剤の国際共同第Ⅲ相試験(CONVERT試験)では、めまい、耳鳴、難聴などの聴器毒性に関連する有害事象が対照群に比べ高い頻度で認められました(18.4% vs. 10.7%)。Grade 3以上の事象は認められませんでした。
聴器毒性に関連する有害事象の発現状況:国際共同第Ⅲ相試験(CONVERT試験)安全性解析対象集団
※タップすると画像が拡大します。
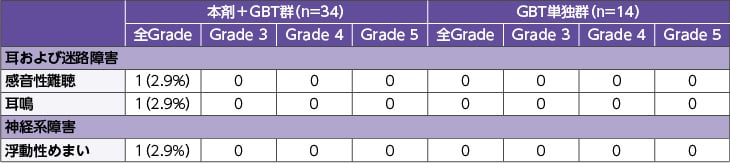
日本人における聴器毒性に関連する有害事象の発現状況:国際共同第Ⅲ相試験(CONVERT試験)日本人安全性解析対象集団
※タップすると画像が拡大します。
- 本剤による治療中は、聴覚又は前庭機能障害が既知又は疑われる患者及び本剤の血中濃度が高くなるおそれがある患者(腎機能障害患者、高齢者、長期間投与患者等)では、聴力検査を実施し綿密にモニタリングすることが望まれます。
- 聴器毒性が発現した場合は、本剤を中止する可能性を含め、適切な処置を行ってください。
アミノグリコシド系抗菌薬による難聴は内耳性ですが、多くが不可逆で一旦難聴をきたすと回復は困難であり、患者の生活の質(Quality of Life; QOL)が大きく低下します。一定の累積投与量により発現することが多いとされますが、患者によって少量や少ない投与回数で難聴をきたす場合もあります。
- 症状:
- めまい、耳鳴、会話の聞き返し/聞き落とし。
- 予防:
- アミノグリコシド系抗菌薬による難聴はミトコンドリア遺伝子1555A→G変異、及びミトコンドリア遺伝子1494C→T変異と関連があることが分かっており、アミノグリコシド系抗菌薬による難聴者が血縁者にいる場合にはミトコンドリア遺伝子変異の有無を検査し、薬物カードを配付して予防に努めることが重要です。
- 治療:
- 薬剤の投与を中止します。